香りと安眠についての論文がありましたので紹介いたします。これまで例えばラベンダーの香りが安眠に良いなどと言われることがありましたが、具体的に体がどういう反応を示しているのかなどは、実験の方法などによりとらえられ方が難しい部分もありました。
被検者へのストレスを極力減らす方法で、微妙な心理的反応を見た実験の論文です。

余談ですが、いびきを止めるのにカレーの臭いをかがせるという方法があるそうです。いびきの原因である気道の狭小化をもたらす胃食道逆流症が、カレーの臭いにより胃が刺激されて、一時的に改善されるのではないかと個人的な興味があります。
http://www.kinki-shasej.org/upload/pdf/kaori.pdf
香りと睡眠
The effect of odor inhalation during sleep
滋賀大学 教育学部 健康科学研究室
Faculty of Education, Shiga University
大平 雅子 Masako OHIRA
キーワード:睡眠(sleep)、香り(odor)、バイオマーカー(biomarker)、唾液(saliva)、
オルファクトメーター(olfactometer)
1.新たな睡眠評価指標の提案
睡眠障害による経済損失は年間 3 兆 4,700 億にものぼるという試算があるように 1),現在,睡眠に纏わる諸問題は個々人のみならず,社会・経済においても重大な関心事となっている.本来睡眠は日々の疲れを癒すものであり,脳や身体にとって必要不可欠な活動である.
しかしながら一方で,現代社会においては睡眠時間の減少や夜型生活による睡眠の質の低下が進行しており 2),睡眠が健康状態に直接的な影響を及ぼす例も相次いで報告されている 3, 4).こうした背景から,睡眠環境における「精神的な」影響・負担を正確に評価することの重要性が増してきている.
一方,人間の精神的なストレスを体内に分泌されるホルモン等の生化学物質により,客観的に(物質的に)評価する試みがなされている 5).現在最もよく用いられている精神的ストレスマーカーの指標として,コルチゾールがある.コルチゾールはアカデミックな口頭試問など,急性でかつ強い社会心理的なストレッサーに対して唾液中や血中の濃度が増加することが知られており 6),ストレスの物質的指標(ストレス・バイオマーカー)として期待されている.特に,起床後 30‐60 分に濃度が上昇する起床時コルチゾール反応(cortisol awakening response: CAR)7, 8)には慢性的なストレスとの関連も数多く報告されている 9. 10).
ストレス・バイオマーカーはコルチゾールの他にも 10種類以上研究されており,前述した睡眠環境における「精神的な」負担を評価する方法論としても期待できる.しかしながら,我々が知る限り,これまで睡眠中にこれらストレス・バイオマーカーを検証した研究は例えばSpiegel ら(2004)11)などごく僅かである.またさらに,同研究を含め,検体として血液を用いている研究は,そもそも血液採取による精神的な負担が無視できないと想像される.そこで,我々は生体試料として唾液に着目し,唾液中に分泌される標記ストレス・バイオマーカーを経時的に定量する手法を提案する.また,本研究において注目する物質は,コルチゾール,免疫グロブリン A 型(secretory Immunoglobulin A: sIgA),α アミラーゼの3 種類である.コルチゾールは CAR について数多くの知見があるが,睡眠中の唾液による定量の報告は無い.一方,sIgA と α アミラーゼも急性ストレスのマーカーとしてよく研究されているものの 12-15),やはり睡眠中の濃度変化については知られていない.
以上をまとめると,睡眠の状態(あるいは睡眠の質)を客観的に評価することは現代社会において重要な課題である.しかしながら,従前の血液採取による手法では心身にかかる負荷が大きく,とりわけ精神的な影響を正確に測定できないと想定される.これに対し, 我々は非侵襲的な方法で睡眠中の唾液を断続的に採取する方法を提案する.本研究ではこの方法を用いて,睡眠中及び睡眠前後におけるストレス・バイオマーカーの変化を経時的に捉え,睡眠様態の新たな評価手法の提案とその応用可能性について検証した.
1.1 評価方法
1.1.1 被験者
男子大学生を対象とし,本研究に関する説明と被験者として協力することの要請を行った.承諾を得られた男子大学生 10 名(22.8±1.0 歳)を被験者とした.被験者は罹患しておらず,また薬物などの処方も受けていないことを確認した.実験に際しては,被験者よりインフォームド・コンセントを得た.
なお,本実験は事前に長岡技術科学大学倫理審査委員会の承認を受けて実施された.
1.1.2 実験手続き
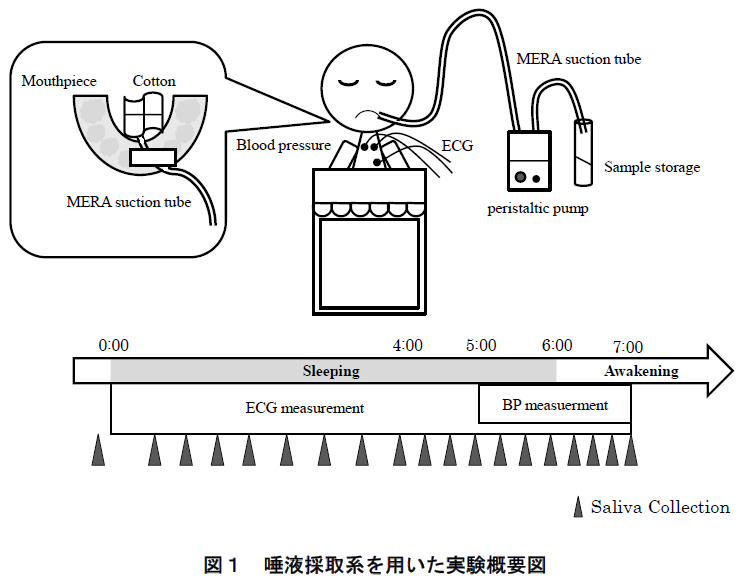
図1に実験の概要を示す.本研究では,各被験者に対して6時間の就寝時間中および起床後1時間にわたる唾液を採取し,唾液中の生化学物質を分析した.以下にその詳細を述べる.
本研究では被験者に午前 0 時に就床させ,午前 6 時に起床させた.ただし,就寝時間・起床時刻を統制する意図により,被験者にはあらかじめ起床時刻(午前 6 時)は知らせなかった.実験当日,被験者には 22 時までに実験室に入室してもらい,実験の説明,インフォームド・コンセント,および測定機器の装着・動作確認を行った.実験は空調管理された実験室(平均室温 22°C, 平均湿度 55%)において 1 晩(22 時~翌朝 7 時まで) に 1 人ずつ実施した.
また,被験者が午前 6 時(起床予定時刻)よりも前に 自然に覚醒してしまう可能性を低減させる意図により, 全被験者に対してそれぞれの実験実施日の 3 日前から 午前 0 時前に就床し,6 時間以上の睡眠をとるよう指示した.さらに,唾液中の生化学物質の分泌への影響を考慮し,被験者には実験実施日の前日からアルコールの摂取を禁止し,実験開始 1 時間前(21 時)より終了後 (翌日午前 7 時)まで飲食,喫煙,激しい運動を禁止した.また,被験者の就寝中はビデオカメラにより監視を行った.
1.1.3 電気生理指標
生体アンプ(BIOPAC MP150,Biopac System Inc., 米国)により,就床直前から起床後 1 時間までの被験者の心電図(Electrocardiogram:ECG)を測定した. ECG の測定電極は,左鎖骨下窩(N),右鎖骨下窩(-),及び左前脇窩線上最下肋骨(+)の 3 点に配置し(第II誘導),サンプリングレートは 500Hz とした.さらに,連続血圧測定システム(Finometer,Finapres Medical Systems B.V., オランダ)により,起床時刻 1 時間前(午前 5 時)から起床時刻 1 時間後(午前 7 時)までの血圧を測定した.
1.1.4 唾液採取方法
本研究では,カスタムメイドされたマウスピースによる吸引部とペリスタルティックポンプ(Peristaltic pump)(SJ-1211H ペリスタポンプ® 高流量タイプ,ATTO)による輸液部からなる唾液採取系を構成し,睡眠時における継続的な唾液採取を実現させた.マウスピース(NIGHT GUARD ADVANCED COMFORT, Doctor’s Co. Ltd., 米国)は実験当日に被験者が入室してから成形し,装着感を確認した.成形したマウスピースにメラ唾液持続吸引チューブ(SP-2,泉工医科工業株式会社)を固定し,シリコンチューブを介してペリスタルティックポンプに接続した(図 2).メラ唾液持続吸引チューブの先端部分はコットンで保護して長時間の採取による口腔内の鬱血を予防した.
唾液採取は,就床 10 分前,睡眠中(就床後 4 時間は30 分間隔,その後,起床前 2 時間は 20 分間隔),起床直後,20 分後,40 分後,および 60 分後の計 19 回実施した.睡眠中の唾液は上述したペリスタルティックポンプによる方法で採取し,就床前・起床後の唾液は,ストローを使って 3 分間に自然に分泌される唾液を採取した(passive drooling)16).
採取した唾液サンプルは-25°Cの冷凍庫に保存し,コルチゾールと sIgA の定量分析には酵素免疫測定法 ( Enzyme-Linked Immuno Sorbent Assay : ELISA ) (cortisol: High Sensitivity Salivary Cortisol Enzyme Immunoassay Kit, Salimetrics LLC , sIgA : SIgA Immunoassay Kit, Salimetrcs LLC)を用い,α アミラーゼの測定には酵素反応測定(Salivary α-Amylase Assay Kit, Salimetrics LLC)を用いた.

1.2 評価結果
1.2.1 睡眠条件統制
全被験者における実験日前 3 日間の平均睡眠時間 は 7.0±1.1 時間であり,被験者は実験日前 3 日間に与えた指示を遵守していた.全ての被験者は就床後直ぐに就寝したこと(なかなか寝つけなかったという報告は無かった),および,実験中に覚醒しなかったことを内省報告したが,これは実験の記録ビデオにおいても追認された.さらに,実験者は起床予定 時刻(午前 6 時)に被験者が睡眠状態であったことを直接確認し,その後,被験者を起床させた.
1.2.2 電気生理指標
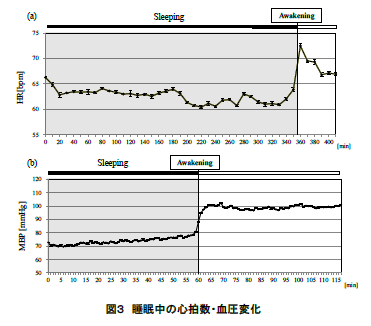
図 3 に ECG より求めた被験者の心拍数の平均値(標準誤差)(図 3(a))および血圧の平均値(標準誤差)(図 3(b))の推移を示す.同図に眺められるように,心拍数・血圧ともに就寝中は低い値で安定的に推移し,起床直後において急激に上昇した.このことからも,本実験において中途覚醒はなく,起床の指示により覚醒したことが示された.
1.2.3 唾液中の生化学物質濃度
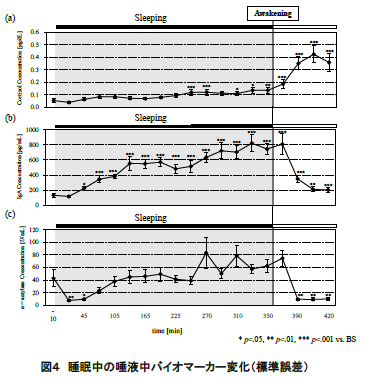
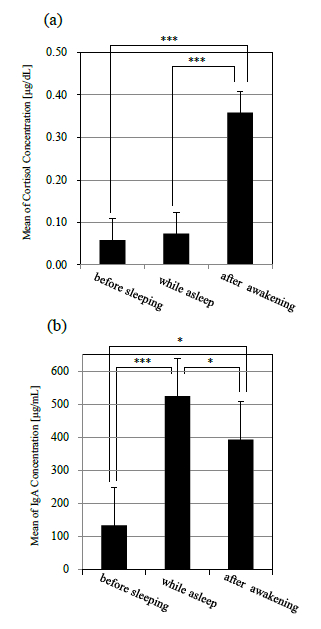
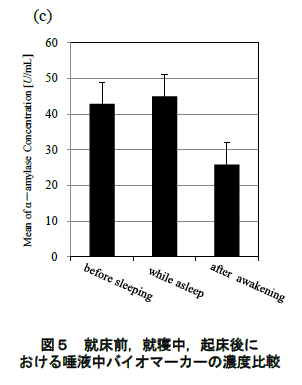
図 4 に唾液により定量したコルチゾール,sIgA,αアミラーゼの濃度変化(平均値±標準誤差)を示す.また,就床前,就寝中,起床後のコルチゾール, sIgA,αアミラーゼそれぞれの平均値の濃度比較を 図 5 に示す.統計処理については一元配置分散分析および Bonferroni 法による多重比較を検討した.全 ての検定について有意水準は 5%とした.
1.2.3.1. 唾液コルチゾール濃度
図 4(a)に示されるように,コルチゾールは就床前から就寝中にかけてほぼ濃度変化は認められなかった.その後,起床直後から徐々に濃度が上昇し,起床 40 分後にピークに達した.また,就床前,就寝中,起床後を比較すると,コルチゾール濃度では就床前,就寝中から,起床後にかけて濃度が有意に上昇した(p<.001)(図 5(a)).
1.2.3.2. 唾液 sIgA 濃度
図 4(b)に示されるように,sIgA は就寝後徐々に濃度が増加していき,平均値で眺めた場合,6 時間の睡眠中に就寝前の約 5 倍にまで達した.その後,起床直後に急激に濃度が減少し,起床 1 時間後までに就床前とほぼ同程度まで回復した.また,就床前,就寝中,起床後を比較すると,就床前から就寝中にかけて濃度が有意に増加し(p<.001),その後,起床とともに上昇した濃度が有意に減少した(p<.05)(図 5(b)).
1.2.3.3 唾液αアミラーゼ濃度
図 4(c)に示されるように,αアミラーゼは就寝直後に減少し,睡眠中には徐々に濃度が上昇していった.起床後は sIgA と同様に起床後 20 分までに急激に濃度が減少し,その後は安定したレベルを示した.また,就床前,就寝中,起床後を比較しても,有意な変動は認められなかった(図 5(c)).
1.2.3.4. 生化学物質間の相関
sIgAとαアミラーゼは比較的似た傾向の濃度変化を示しており,2 つの物質間には有意な正の相関が認められた(r=0.55, p<.001).一方,コルチゾールは,sIgAあるいはαアミラーゼとの間に有意な相関関係は認められなかった(sIgA:r=-0.09, p>0.05, αアミラーゼ:r=1.93, p>.05).
1.3 考察
1.3.1 睡眠中の唾液採取について
本研究では内省報告および心拍数・血圧により全被験者が就床時刻帯(あるいは,少なくとも午前 1 時から午前 6 時)において睡眠状態にあったこと,また,起床時刻に実験者の指示により覚醒したことが確認できた.また,唾液の採取においては各生化学物質の定量分析に必要充分な量の唾液が採取できた.
したがって,我々が構築した唾液採取系により,被験者を中途覚醒させることなく,当初の期待通り唾液を継続的に採取することができた.
1.3.2 唾液中の生化学物質の変動特性
1.3.2.1 就寝中の生化学物質の変動特性
本研究では睡眠時に唾液中に分泌される 3 種類の物質(コルチゾール・sIgA・α アミラーゼ)の経時変化を検証した. 過去の研究において“日中”に採取された検体の定量分析により,各物質には朝に濃度が高く夜にかけて減少するという概日変動が報告されている 7, 8, 17, 18).しかしながら,本研究結果を眺めた場合,sIgA と αアミラーゼでは既に就寝中から濃度の増加が認められ, コルチゾールでは就寝中は一定のレベルを保ち,起床後に初めて増加することが詳細に示された.したがって,コルチゾール・sIgA・α アミラーゼは一様に朝高夕低の概日変化を示すものの,就寝中には異なる分泌特性をもつことが示され,これは本研究により得られた新しい知見である.
1.3.2.2 起床時コルチゾール反応(CAR)研究の課題 と本研究の方法論
諸言に述べたように,CAR は日常的なストレス状態を反映する評価指標として注目を集めている 7, 8).過去のCAR 研究によると,コルチゾールは起床後 30~60 分の 間にその濃度が 1 日のピークを迎えることが報告されている 7, 8).本研究においても,コルチゾール濃度は起床 40 分後にピークに達し,これは先行研究の結果を支持している.ただし,これまでの CAR に関する研究は,“起床直後”からのコルチゾールを定量したものであり,睡眠中から起床後にかけての経時的変化を報告した研究はほとんどない.さらに,CAR 研究はほぼ全てが唾液を用いた研究であるが,それらの研究は多くの場合,被験者自身に自宅で起床時の唾液を採取させている.そのため,起床時刻や“起床直後”という唾液の採取時間が正確に統制されているとは言い難く,翻って起床時のCAR が観察されていない場合も散見される.実際, Michaud ら(2006)の CAR 研究ではやはり自宅で行ったセッションにおいて起床時刻が統制できていないことが示されており,実験統制上の課題として挙げられている 19).
先行研究において,唯一睡眠中のコルチゾールの経時変化を報告しているのが,Spiegel ら(2004)の研究である 11).しかしながら,同研究では起床予定時刻の前からコルチゾールの増加が認められ,ひいては起床後のCAR も明確には認めることができない.これは,実験条件における睡眠時間(より正確には「ベットに居る」時間)の設定が 8-12 時間睡眠と非常に長いため,被験者が 途中覚醒していることに由来すると考えられる.
また,何よりも同研究では 24 時間の間に 10~30 分間隔で採血を繰り返し行っており,被験者の精神的・肉体的負担は甚大であると想定され,明確な CAR が観察されなくても不思議ではない.
これに対し,本研究で用いた唾液連続採取による評価方法は被験者への負担も非常に小さく,また被験者の途中覚醒も生じない.したがって,本研究で構成した唾液採取方法は睡眠時および起床時の生化学物質の変動特性を検証する上で有用な方法であると考えられる.
1.3.2.3 生化学物質間の変動特性の比較
図 5 による物質の変化傾向及び物質間の相関分析の結果,sIgA と α アミラーゼ間には弱いながらも正の相関が認められた.また,その濃度は睡眠中から徐々に増 し,起床直後にピークを迎えるという類似した変化傾向を示した.これに対し,コルチゾールでは起床後に濃度が上昇し始めるという全く異なる変化傾向を示した.これらの生化学物質間の変動特性の差異は,それぞれの物質の分泌機序に由来しているのかもしれない.生体にストレスが負荷されると視床下部―下垂体―副腎の内分泌系(HPA 系)と視床下部で分かれて橋―延髄―脊髄―副腎髄質の自律神経系(NA 系)の 2 つの系が腑活されることが知られている 5, 20).コルチゾールはHPA 系のストレス応答ホルモンであり,ノルアドレナリン系に関連した物質である α アミラーゼ,および免疫系物質である IgA は NA 系の物質であることが知られている5, 20).したがって,これら生化学物質の経時変化はそれぞれの物質の分泌機序(HPA 系と NA 系)を反映している可能性が考えられる.ただし,この点は他の HPA 系・NA 系の生化学物質の分泌の様態も明らかにしなければならず,本稿でこれ以上の議論をすることはできない.
1.3.2.4 本研究の制約
本研究で構成した唾液採取系は,睡眠中の唾液を継続的に採取することを可能にした上,仕組みが非常に簡便であり,操作方法も容易である.これまで睡眠中の内分泌系指標の評価には,採血が必須であったが,本研究の方法を用いれば,非侵襲的な方法で生化学物質の定量が可能になり,被験者の負担も軽減し得る.ただし,一般に睡眠時の唾液分泌量は覚醒時や,刺激を与えた場合と比べて減少することが知られており,少ない唾液量を出来るだけ安定して確保が行えるように今後工夫の余地もある. また,本研究の参加者は全員が男子大学生(21~24歳)であり,唾液分析に係るコストの制約から被験者の数も小規模である(10 名),したがって,本研究を解釈するうえで,被験者選択によるサンプリングバイアスには充分注意が必要である.
2. 香りを用いた介入研究
香りの効能は,近年,心理学または生理学の分野で実証的に研究がなされ多くの知見がもたらされている. 例えば,ラベンダーは,リラックス状態の促進および副交感神経の亢進作用をもつことが知られている 21, 22).一方で,ジャスミンは抑うつ状態の改善や気分の向上を示す効果および交感神経の亢進作用をもつことが知られている 23).しかしながら,これまでの香りの生理・心理研究は,その殆どが脳・中枢神経系や自律神経に対する効果を評価したものである.これに対し,本研究で扱う内分泌系に対する生理効果を検証した研究報告は極めて少ない. 例えば,Fukuiら(2007)は,ジャコウ,またはローズの香りが急性ストレス刺激に対するコルチゾールの分泌を抑制することを報告している 24).しかしながら,香りに対する内分泌系の効果についての研究は未だ限定的であり統一的な理解はなされていない.
そこで,本研究では先行研究 25)で構築した実験系を踏襲し,ラベンダーが内分泌系に及ぼす効果を検討した.更にラベンダーと拮抗する作用を有すると想定されるジャスミンについても検証した.
2.1 評価方法
2.1.1 被験者
本研究の被験者は,実験参加への承諾が得られた男子大学生 18 名(平均年齢(標準偏差):22.0(1.2)歳, 平均 BMI(標準偏差):23.0(5.0))であった.被験者はいずれも健常者であり,薬物等の処方も受けていないことを確認した.ただし,この内 2 名は定量分析に必要な唾液量が採取できず分析から除外した. なお,本実験は事前に長岡技術科学大学倫理審査委員会の承認を受けて実施された.
2.1.2 実験手続き
本研究の概要を図 6 に示す.実験は空調管理された実験室(平均室温 24.6°C,平均湿度 51.9%)において 1 晩(23 時から翌朝 7 時まで)に 1 人ずつ実施した. 被験者の就寝時間は合計 6 時間であり,午前 0 時に就床させ,実験者が午前 6 時に被験者を起床させた.
また,被験者が午前 6 時(起床予定時刻)よりも前に自然に覚醒してしまう可能性を低減させる意図により, 全被験者に対して,実験初日の 5 日以上前から睡眠統制(1午前 0 時までに就床する,2毎日 6 時間以上の睡眠を確保する)を実施した.各被験者の睡眠統制の状況については就寝前・起床後にメールで報告させることで確認した.
さらに,唾液中の生化学物質の分泌への影響を考慮し,実験実施日の前日からアルコール摂取の禁止,実験開始 2 時間前(21 時)より終了(翌日午前 7 時)までの間の飲食・喫煙・激しい運動・入浴を禁止した.また,就寝中の被験者の様子をビデオカメラにより観察した.
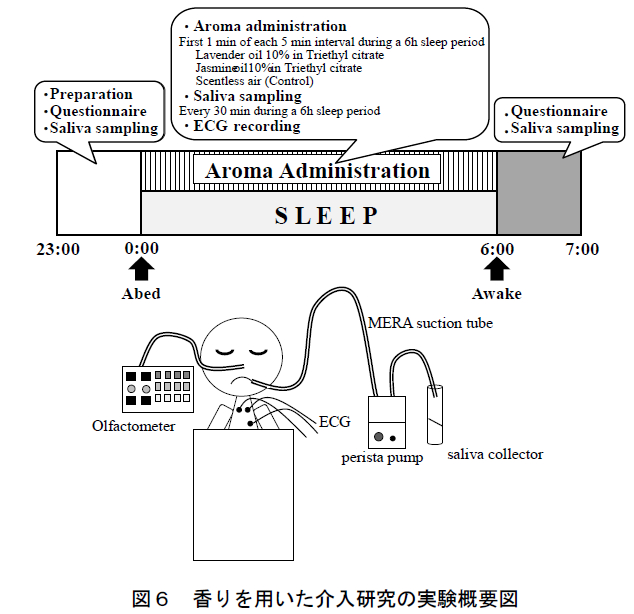
2.1.3 香りの呈示条件
本研究では,香り条件としてラベンダー精油(フランス産,高砂香料工業株式会社),およびジャスミン精油(モロッコ産,高砂香料工業株式会社)を用いた.また,コントロール条件として無臭空気を用いた.精油は,それぞれ無臭溶媒のクエン酸トリエチル(Triethyl cit-rate: TEC) を用いて 10 wt%に希釈した.
香りおよび無臭空気の呈示は,マルチチャンネル・オルファクトメーター(株式会社テクニカ(東京都)設計・製作)により制御した.本研究では同装置により,被験者の鼻孔直下に設置したカニューレを用いて香りを呈示した.香りの呈示は,5 分毎に 1 回・1 分間とし,これを被験者の就寝時間(午前 0 時から 6 時)中,断続的に繰り返した(合計 72 回(同分)).実験初日は第 1 夜として解析から除外し,残りの 3 条件は順序効果に配慮した被験者内デザインにより比較した.また,各条件の実施日には,3 日以上のインターバル期間を設けた(各被験者は約 20 日間の期間に計 4 回実験を実施した).
2.1.4 電気生理指標
生体アンプ(PolymateII,ティアック株式会社)により,就床直前から起床後 1 時間までの被験者の心電図 (Electrocardiogram:ECG)を測定した. ECG の測定電極は,左鎖骨下窩(G),右鎖骨下窩(-),及び左前脇窩線上最下肋骨(+)の 3 点に配置し,サンプリングレートは 500Hz とした.
2.1.5 唾液の採取方法・分析
唾液採取は,就床 10 分前,就寝中(30 分毎・計 12回),起床後(0分,15分,30分,45分,および60 分後)の計 17 回実施した(図 1).睡眠時の継続的な唾液採取には,我々が過去の研究で独自に構築した唾液採取法を用いた 26).就床前・起床後の唾液は,ストローを使って 3 分間に自然に分泌される唾液を採取した(passive drooling 法)16).
採取した唾液は定量分析の日まで-25°Cの冷凍庫に保存した.唾液のコルチゾールの定量分析には,酵素免疫測定法(Enzyme-linked immuno-sorbent assay: ELISA ) ( High Sensitivity Salivary Cortisol Enzyme Immunoassay Kit, Salimetrics LLC., 米国)を用いた.
2.1.6 心理指標
被験者の睡眠前後の心理状態を評価するため,就床前と起床直後に日本語版 POMS 短縮版 26)に回答させた.この心理指標は, T-A: 緊 張-不 安( Tension- Anxiety),D:抑うつ-落込み(Depression-Dejection), A-H:怒り-敵意(Anger-Hostility),V:活気(Vigor), F:疲労(Fatigue),C:混乱(Confusion)の 6 つの気分尺度について,それぞれに対応する計 30 項目の質問からなる.
2.2 評価結果
2.2.1 電気生理指標
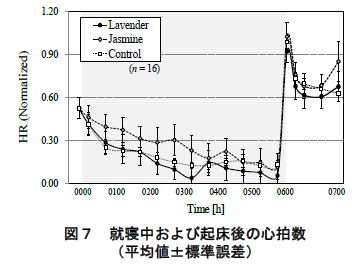
図 7 に ECG より求めた被験者の心拍数の平均値(標準誤差)の推移を示す.ただし,心拍数は個人差が大きいため,被験者・実験条件毎の心拍数の最小-最大値 を 0~1 に規格化している.また,平均値の算出区間については後述するコルチゾール定量のための唾液採取区間に準じている.同図に眺められるように,心拍数は就寝後徐々に減少していき,その後,起床直後に急激に上昇し,ピークに達した.この変動傾向は,いずれの香り条件においても同様であった.
一方,ジャスミン呈示時において,就寝後 1 時間半の心拍数(平均値)がコントロール条件よりも高い傾向が認められた(p< 0.10,Bonferroni 補正 t 検定).
2.2.2 唾液中のコルチゾール濃度
図 8 に唾液により定量したコルチゾールの濃度の平均値(標準誤差)を示す.ただし,同図はコルチゾール分泌における個人差を考慮し,被験者・実験条件毎のコルチゾール分泌の最小-最大値を 0~1 に規格化し ている.同図に示されるように,コルチゾールの分泌は就寝後徐々に濃度が増加していき,平均値で眺めた場合,6 時間の睡眠中に就寝前の 3~4 倍に達した.その後,起床直後より濃度が顕著に上昇し,起床 30~45 分後 にピークに達した.この変動傾向は,いずれの香り条件においても同様であった.
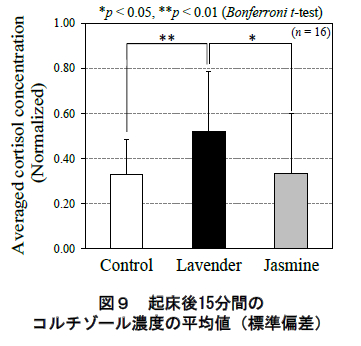
一方,各香り条件における起床直後(6:00)と起床後15 分(6:15)のコルチゾール濃度の平均値(標準偏差)を図 10 に示す.同様に,同図でも被験者毎のコルチゾール分泌を規格化した値を用いている.同図に示されるように,起床後 15 分間のコルチゾール濃度の平均値にお い て ,ラ ベン ダ ー 呈 示 時 は ジ ャ ス ミ ン ( p<0.05,Bonferroni 補正 t 検定)およびコントロール(p<0.01, 同t 検定)より有意に濃度が高かった.

2.2.3 心理指標
表 1 に就床前と起床直後に回答させた日本語版POMS 短縮版の得点(標準偏差)から,各香り条件における睡眠前後の主観的な気分の変化を示す.同表に示すとおり,疲労感(要因「F(疲労)」)において,ラベンダー呈示時はジャスミンよりも有意に疲労感が回復し(p<0.05, Bonferroni 補正 t 検定),またコントロールに対してもその傾向が認められた(p<0.10, 同 t 検定).
2.3 考察
本研究は,香りが睡眠中の内分泌系に及ぼす効果を明らかにするために,就寝中の香り呈示に対する唾液中コルチゾールの分泌を評価した.その結果,図 8 に示すように,就寝中のラベンダー呈示により(香りを呈示していない)起床後のコルチゾール分泌の増大が認められた.
もともと,コルチゾールには起床後に 1 日のピークを迎える“起床時コルチゾール反応(cortisol awak-ening response: CAR)”と呼ばれる分泌特性がある 7, 8).しかしながら,本研究で観察されたラベンダー呈示による起床後のコルチゾール分泌の増加は,次に挙げる2つの理由から,この CAR とは別の生理機序を背景とする生理効果であると考えられる.
第一に,ラベンダーの呈示によるコルチゾールの分泌への影響が起床直後~15 分に限定されていた点が挙げられる.CARはコルチゾールの濃度が起床 30~45分後に 1 日のピークに達する顕著な分泌特性である 7, 8). 本研究においても図 8 のコントロール条件で起床後 45分をピークとする CAR が確認できる.ただ同時に同図に認められる様に,本研究では香り条件間でこの CARのピーク値には差異は認められなかった.その一方で, 通常 CAR がピークを迎えるよりも“前の”時間帯-起床直後~起床後 15 分-においてコルチゾールの分泌に有意な差異が認められた(図 9 および図 8:矢印).したがって,本研究で観察された起床後のラベンダーの分泌動態は,通常の CAR の他にラベンダー自体による(起床直後の)生理効果が重畳したものであったと考えられる.
第二に,通常 CAR の増大は心理状態の悪化を示唆するが,本研究ではラベンダーの呈示によりむしろポジティブな心理状態が導かれた点が挙げられる.生体にストレスが負荷されるとコルチゾールの分泌,あるいはその起床時反応である CAR も増大することが知られている9, 10).これに対し,本研究ではラベンダーの呈示によりコルチゾールの分泌が増大した一方で(図 9),同時に疲労感(要因「F(疲労)」)の改善傾向も認められた.したがって,本研究で観察されたコルチゾールの増加は,少なくとも心理的なストレスが媒介する生理的なストレス反応ではないと考えられる.
一方,このラベンダーによるコルチゾールの分泌変化は,自律神経系が直接的に関与する生理応答であるとは考えにくい.CAR と自律神経活動の関係性については交感神経 27)あるいはその反対に副交感神経 28)との関連が報告されているものの,研究数はごく僅かであり統一的な理解も得られていない.本研究でも,ジャスミン呈示時に就寝時の心拍数低下が抑制される傾向が認められた(図 7)ものの, CAR 自体はジャスミンとコントロール条件において差異は認められなかった.その反対に,就寝中の心拍数においてコントロール条件と差が無かったラベンダーにおいて起床時のコルチゾール分泌に有意な差が認められた.つまりラベンダーで観察された起床後 15 分間のコルチゾールの増大は自律神経系を介する生理応答とは考えにくい. このことについて,本稿の中でこれ以上の考察を進めることは難しい.今後, 中枢神経系を含む統合的研究が望まれる.

3. まとめ
我々の研究により,就寝中のラベンダーの呈示により,“起床直後”から HPA 系が活性化される場合,それはむしろ起床時の生理的な覚醒を促し,心理的には疲労回復効果をもたらすのかもしれないことが示唆された.
香りには,個人の好み・感受性に依存しない一定の生理効果があることは明らかである.しかしながら,その効果がポジティブなものであるのか,ネガティブなものであるのかという議論は尚早である.これまでの研究では, 香りの定量的な呈示方法が確立しておらず,再現性に大きな問題がある.呈示方法のばらつきには,呈示手段 (例えば,試香紙,ディフューザー,精油を直接嗅ぐ)以外にも,濃度や呈示時間等多くの可変要素が含まれる.こうした背景から,ヒトの心身へもたらす影響については統一的な理解がなされていない.
さらに,評価軸の問題がある.我々は,既述したように,就寝中の体内のホルモンレベルが特定の香りによって大きく変動することを明らかにした。これらの成果は, 我々が開発した新しい方法論により明らかになったものである.この方法論を用いたことで,ホルモンを睡眠評価における新機軸として導入することが可能になり,これまで捉えることができなかった香りの影響を明らかにすることができた.したがって,今後も従来の指標に新たな指標を組み合わせた統合的な評価方法を用いることで,香りの効果をより正確に評価することが可能になる.
将来的に,香りを日常生活や医療現場の中で用いるためにも,「香り」が心身にもたらす影響については,現時点ではひとつひとつ基礎的な知見を積み上げていくことが重要である.
【参考文献】
1) 武村真治,等:高齢者睡眠障害の対応と予防.
Geriatr Med, 45(6): 679-685, 2007.
2) NHK 放送文化研究所:日本人の生活時間―NHK 国民生活時間調査―.日本放送出版会,2006.
3) Ayas NT, et al.: A prospective study of sleep duration and coronary heart disease in women. Arch Intern Med, 163(2): 205-209, 2003.
4) Breslau N, et al.: Sleep disturbance and psychiatric
disorders: a longitudinal epidemiological study of young adults. Biol Psychiatry, 39(6): 411-418, 1996.
5) 井澤修平,等:唾液を用いたストレス評価.日本補
完代替医療学会誌,4(3): 91-101, 2007.
6) Dickerson SS & Kemeny ME: Acute stressors and
cortisol responses: A theoretical integration and synthesis of laboratory research, Psychol Bull, 130(3): 335-391, 2004.
7) Pruessner JC, et al.: Free cortisol levels after
awakening: a reliable biological marker for the assessment of adrenocortical activity. Life Sci. 61: 2539-2549, 1997.
8) Clow A, et al.: The awakening cortisol response:
methodological issues and significance. Stress, 7(1): 29-37, 2004.
9) Izawa S,et al.: Episodic stress associated with
writing a graduation thesis and free cortisol secretion after awakening. Int J Psychophysiol. 64(2): 141- 145, 2007.
10) Schulz P, et al.: Increased free cortisol secretion after
awakening in chronically stressed individuals due to work overload. Stress Med. 14(2): 91–97, 1998.
11) Spiegel K, et al.: Leptin levels are dependent on
sleep duration: relationships with sympathovagal balance, carbohydrate regulation, cortisol, and thyrotropin. J Clin Endocrinol Metab, 89(11): 5762- 71, 2004.
12) Chatterton RTJ, et al.: Salivary alpha-amylase as a
measure of endogenous adrenergic activity. Clin Physiol, 16(4): 433-448, 1996.
13) Rohleder N, et al.: Psychosocial stress-induced
activation of salivary alpha-amylase: an indicator of sympathetic activity? Ann N Y Acad Sci, 1032: 258- 263, 2004.
14) Ring C, et al.: Secretory immunoglobulin A and
cardiovascular reactions to mental arithmetic, cold pressor, and exercise: effects of alpha-adrenergic blockade. Psychophysiology, 37(5): 634-643, 2000.
15) Spangler G: Psychological and physiological
responses during an exam and their relation to personality characteristics. Psychoneuroendocrinology, 22(6): 423-441, 1997.
16) Strazdins L, et al.: Impact of saliva collection methods on sIgA and cortisol assays and
acceptability to participants. J Immunol Methods, 307(1-2): 167-71, 2005.
17) Hucklebridge F, et al.: The relationship between
salivary secretory immunoglobulin A and cortisol: neuroendocrine response to awakening and the diurnal cycle. Int J Psychophysiol, 31(1): 69-76, 1998.
18) Nater UM, et al.: Determinants of the diurnal course
of salivary alpha-amylase. Psychoneuroendocrinology, 32(4): 392-401, 2007.
19) Michaud DS, et al.: Waking levels of salivary
biomarkers are altered following sleep in a lab with no further increase associated with simulated night- time noise exposure. Noise Health, 8(30): 30-39, 2006.
20) Bosch JA, et al.: Stress and secretory immunity. Int
Rev Neurobiol, 52(1): 213-253, 2002.
21) Diego MA, et al.: Aromatherapy positively affects
mood, EEG patterns of alertness and math computations. Int J Neurosci, 96(3-4), pp.217-224, 1998.
22) Field T, et al.: Lavender fragrance cleansing gel
effects on relaxation. Int J Neurosci, 115(2), pp.207- 222, 2005.
23) Hongratanaworakit T: Stimulating effect of
aromatherapy massage with jasmine oil. Nat Prod Commun. 5(1), pp.157-162, 2010.
24) Fukui H, et al.: The effect of odor on cortisol and
testosterone in healthy adults. Neuroendocrinology Letters, 28(4), pp.433-437, 2007.
25) 大平雅子,等:唾液中 Cortisol, sIgA, α-amylase 濃度の睡眠時変化特性.生体医工学,49(6), pp.798-804, 2011.
26) 横山和仁:POMS 短縮版手引きと事例解説.金子
書房,2005.
27) Izawa S, et al.: The cortisol awakening response and autonomic nervous system activity during nocturnal and early morning periods. Neuro Endocrinol Lett, 31(5), pp.685-689, 2010.
28) Stalder T, et al.: Associations between the cortisol awakening response and heart rate variability. Psychoneuroendocrinology, 36(4), pp.454-462, 2011.
ストレス減で活力ある未来に貢献する、株式会社RUDDER。
特許出願済み。まぶしい!うるさい!寒い!を解消。安眠家具「Sleep Labo」国産家具の安心安全をお届けします。
うるさいいびき、止まらない、止められない。でも大丈夫。 いびきを解決する唯一の方法。


