https://www.jstage.jst.go.jp/article/jim/31/3/31_143/_article/-char/ja/
入江潤一郎ほか:睡眠と腸内細菌叢 143
総 説 腸内細菌学雑誌 31 : 143-150,2017
特集:脳神経系と腸内細菌叢 Microbiota
睡眠と腸内細菌叢
入江 潤一郎*,伊藤 裕*
慶應義塾大学医学部腎臓内分泌代謝内科
Sleep and Intestinal Microbiota
Junichiro IRIE*, Hiroshi ITOH
*Division of Endocrinology, Metabolism and Nephrology, Department of Internal Medicine,
School of Medicine, Keio University
要 旨 睡眠は sleep homeostasis と,中枢の時計遺伝子の支配を受ける概日リズム(circadian-rhythm)により制御されている.末梢臓器である腸管も時計遺伝子による制御を受け,腸内細菌の組成と機能には概日リズムが認められる.時差症候群や睡眠時間制限などによる睡眠障害は,腸内細菌の概日リズムに変調をもたらし,dysbiosis や腸管バリア機能低下を惹起し,宿主のエネルギー代謝異常症の原因となる.規則正しい摂食は腸内細菌の概日リズムを回復させ,中枢時計との同調を促し,睡眠障害の治療となる可能性がある.またプレ・プロバイオティクスなど腸内細菌を介した睡眠障害の治療も期待されている.
Abstract The sleep-wake system is regulated by two processes: the sleep homeostasis and the clock-dependent alertness regulated by the central clock in the suprachiasmatic nucleus. Peripheral organs such as the intestine and liver are regulated by the peripheral clocks, and intestinal microbiota show diurnal oscillations in composition and function. Sleep disturbances due to jet lag or sleep deprivation disrupt microbiota diurnal oscillations, impact gas- trointestinal tract function, produce dysbiosis, and drive metabolic disarrangements in the host. Regular feeding pat- terns can restore the diurnal oscillation of intestinal microbiota, promote entrainment to the central clock, and solve sleep disorders. Moreover, treatments with prebiotics and probiotics to improve sleep quality have been extensively investigated. Key words : sleep-wake system;central clock;peripheral clock;diurnal oscillation;intestinal microbiota;sleep disturbance
は じ め に
近年,睡眠が身体・精神活動に様々な影響を与えていることが明らかとなり,不眠に代表される睡眠の障害が, 糖尿病・高血圧・肥満症など生活習慣病の発症リスク となることなどが疫学調査により示されている(1, 2). 良質な睡眠を獲得することは,生活習慣病を代表とする 様々な疾病の予防・治療に重要であると考えられ,新規薬物の開発が盛んになされている.しかし,睡眠そのものの分子メカニズムの理解は十分とはいえず,また睡眠障害には不眠症や概日リズム睡眠障害など多彩な病態が含まれるため,睡眠障害の治療は単純ではない.
睡眠が腸管機能に影響を与えることは古くから知られ ている.シフトワーカーや長時間旅行者などに代表される不規則な生活の集団では,消化管症状を訴える頻度が多いことや,睡眠障害が過敏性腸症候群や逆流性食道炎 のリスクとなることが知られている(3).その機序としては,睡眠障害がストレスとなり,交感神経の活性化やコルチゾールの分泌増加をもたらすことなどが想定されてきたが,最近の腸内細菌の分子生物学的検討により,腸内細菌に日内変動が認められることが見いだされ (4, 5),睡眠の変化が腸内細菌の組成や機能にも影響を与えていることが明らかとなってきた.
さらに腸内細菌の機能解析が進んだことで,睡眠の変化によってもたらされた腸内細菌の機能変化が,宿主のエネルギー代謝に影響を与え,肥満やインスリン抵抗性の誘因となることも明らかとなってきた.また腸内細菌が宿主の睡眠にも影響する可能性も示され,腸内細菌を介した睡眠の治療,さらには生活習慣病の治療が期待されている.
そこで本稿ではまず,現在考えられている睡眠の生理と概日リズムについて述べ,腸管と腸内細菌に対する概日リズムと睡眠の影響について概説し,最後に腸内細菌を介した概日リズムと睡眠障害治療の可能性について述べたい.
睡眠と概日リズム
睡眠には時計遺伝子によって制御される概日リズムを含め,多くの要因が関係していることが知られているが,大局的には睡眠の調節は,恒常性維持機構と概日リズムによって支配されていると理解されており,2 プロセスモデルと呼ばれている(6, 7).本モデルでは,睡眠は sleep homeostasis(プロセス S)と概日リズム(プロセス C;circadian-rhythm)により調節されているとされる.ホメオスタシスによる睡眠制御とは,覚醒中は睡眠負債が増加し,睡眠により減じるもので,睡眠負債が睡眠閾値に達すると入眠し,覚醒閾値に達すると覚醒するというものである.この閾値が概日リズムによる支配を受けており,日内変動を認めると考えられている(プロセス C).すなわち,日中の覚醒と夜間の睡眠は,覚醒し続けることでたまる睡眠負債と,体内時計からの眠気 (覚醒刺激)で決定するという考え方である(図 1).概日リズムにより生理的に睡眠を促しつつ,環境の変化に 応じた睡眠時間の補償を行うシステムと理解されている.
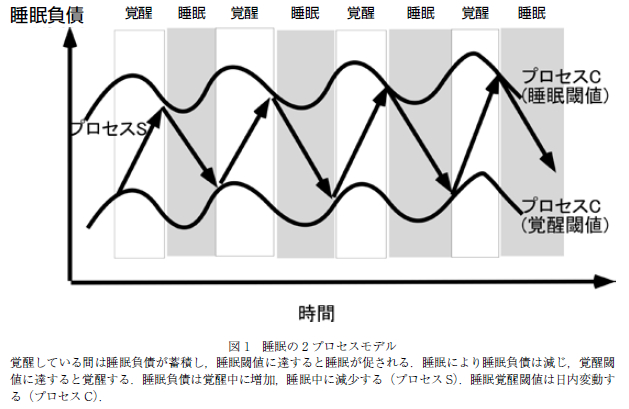
ヒトを含めた哺乳類は,地球の自転とほぼ同じ約 24時間周期で体内環境を変化させており,これは概日リズムと呼ばれている.光刺激などがないところでも概日リズムは維持されることから,本リズムは“体内時計”とも呼ばれ,血圧や体温などの日内変動を決定している(8).哺乳類における概日リズムは,脳の視床下部の視交叉上核(suprachiasmatic nucleus: SCN) が概日時計の中枢であり,他の臓器の概日リズムも制御している.SCN を破壊した動物では規則的な活動ができなくなり,SCN の移植により概日リズムが回復することが報告されている.SCN の 1 つ 1 つのニューロンは 24 時間周期で時計遺伝子の転写がなされ,概日リズムの発振を行っている.SCN のニューロンはネッ トワークを構成し,転写因子 CLOCK,BMAL1,およびその活性を抑制する Period(Per),Cryptochrome (CRY)などにより概日リズムを発信する.実際の概日リズム異常による睡眠障害として,睡眠相前進症候群 (Advanced sleep phase syndrome;ASPS)や睡眠相後退症候群(Delayed sleep-phase syndrome(DSPS) が知られている(9–11).前者では,夕方になると強い眠気が生じ,早朝に覚醒する睡眠パターンを呈し,PER2の遺伝子異常の家系が報告されている.後者では,朝起床できず社会生活が困難となることが認められ, PER3 の遺伝子多型が報告されている(11).
また哺乳類の睡眠では,レム睡眠(Rapid eye movement sleep, REM sleep)とノンレム睡眠(Non- rapid eye movement sleep, Non-REM sleep)が 90分程度のセットで繰り返されている.眠りにつくとまずノンレム睡眠が現れ,その後眠りの浅いレム睡眠が出現する.レム睡眠は,急速眼球運動を伴う睡眠であり,身体は骨格筋が弛緩して休息状態であるが,脳は活動して覚醒している睡眠状態である.大脳皮質は覚醒時よりもむ しろ強く活動しており,脳波は 4 Hz から 7 Hz のシータ波が中心となり覚醒時に近い振幅を示す.急速眼球運動を伴わない睡眠はノンレム睡眠と呼ばれ,いわゆる脳は深い眠りの状態である.脳波は 1 Hz から 4 Hz のデルタ波と呼ばれる低周波,高振幅の脳波が観測され, ノンレム睡眠は脳波の所見から徐波睡眠(slow-wave sleep)とも呼ばれる.ノンレム睡眠とレム睡眠の周期的な変化に関する分子生物学的機序は明らかではない.
※レム睡眠とノンレム睡眠の切り替えを担うニューロンの同定(筑波大学論文)が発表されています。
概日リズム・睡眠と腸管・腸内細菌
概日リズムは中枢性のリズムのみならず,肝臓や消化管などの末梢臓器にも存在することが知られている.腸管における遺伝子発現の 30%程度が概日リズムを示すことが報告されており,腸管上皮の増殖,腸管透過性などに概日リズムが認められ,腸管で合成分泌されるトリグリセリド豊富なリポ蛋白の血中濃度にも概日リズムが認められる(12–14).消化管でも Clock や Bmal1 などの時計遺伝子の発現が認められ,発現は特に下部消化管,大腸に多く,またその発現部位は,粘膜固有層ではなく上皮層が主である(13).これらの時計遺伝子は, グルコースの吸収に関わる SGLT1 や,ペプチドの吸収に関わる PEPT1 などの発現に影響を与え,マウスにおいては糖取り込みに関わるトランスポーターは暗期に,ペプチドのトランスポーターは明期に増加を認める.同 様に脂質の吸収に関しても日内変動を認め,脂質の吸収に関わる遺伝子群は暗期に増加が認められている. Clock 遺伝子変異マウスでは腸管内容物からの糖の吸収が亢進,ペプチドの吸収は低下し,中性脂肪やコレステロールの吸収は亢進していることが報告されている.腸管上皮細胞以外に腸管に存在する細胞として腸管内分泌細胞があるが,腸管内分泌細胞の 1 つであるグレリン産生細胞も Bmal1 や Per1/2 などの時計遺伝子の支配を受けることが報告されており,Bmal1 を欠損したマウスでは,グレリンの日内変動が認められず,摂食の日内変動が認められない(15, 16).また腸管免疫に関わる小腸の toll-like receptor 発現にも概日リズムが認められることが報告されている(17).
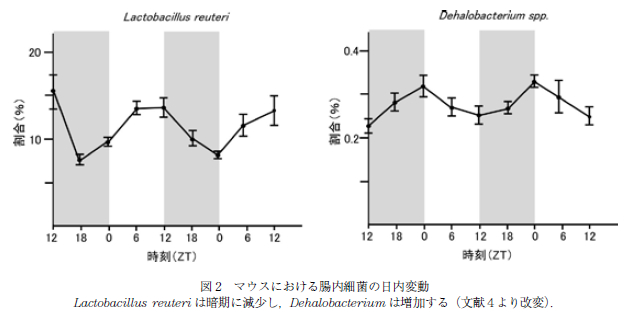
このように,腸管機能に関わる分子に日内変動が認められることから,腸管内腔に存在する腸内細菌に対する 影響が想定され,最近,腸内細菌の日内変動が複数のグループから報告された(4, 5, 18, 19).6 時間ごとの検討で,マウスにおいては Clostridales や Lactobacillaes が日内変動を示すこと,種レベルでは Lactobacillus reuteri が暗期に減少し,Dehalobacterium は増加するという日内変動を示すことなどが報告された(図 2). この腸内細菌の日動変動にともなって,腸内細菌による ビタミン代謝や核酸代謝などにも日内変動が認められ,DNA 修復や細胞増殖,ムチン分解は暗期に,細菌の運動やセンシングに関するパスウェイは明期に優位となっていた.それぞれの報告により,明期と暗期に増減する細菌種は必ずしも一致を見ないが,これはマウスの種や環境の違いを反映していると考えられる.しかしいずれの報告でも,複数の腸内細菌種が日内変動を認めることが明らかとされた.
腸内細菌の日内変動は,時計遺伝子を欠損したBmal1 欠損マウスや Per1/2 欠損マウスでは認められず,前述の細菌機能の日内変動も認められなかった(4, 5).このことから,腸内細菌の日内変動は時計遺伝子の支配を受けていると考えられた.しかし Per1/2 欠損マウスにおいても,時間を定めた食事摂取を行わせることで腸内細菌の日内変動は再現された(4).したがって,腸内細菌に日内変動を生じさせる因子としては,時計遺伝子と摂食が存在し,摂食が腸管のリズム形成により重要であると考えられた.
腸内細菌が時計遺伝子の支配を受け,かつ日内変動を示したことから,時差症候群,または睡眠時間を短くするなどの睡眠障害を起こす介入により,中枢時計の概日リズムを変化させることによる腸内細菌への影響が次に検討された.
明期と暗期を 1 週間ごとに変更する睡眠障害をマウスに与えたところ,大腸での Per2 発現の概日リズムが消失し,高脂肪高糖質食投与時に対照群に比較して,腸内細菌叢は門レベルで Firmicutes の増加,Bacteroidetes の減少が認められた(20).また同様の睡眠障害により,腸管透過性が亢進し,血中 LPS 濃度が増加することも報告された(21).他にも明期暗期のサイクルは変えずに,触覚刺激により睡眠障害をもたらす介入によっても,4 週間の睡眠障害により,Lachnospiraceae と Ruminococcaceae の増加,Lactobacillaceae,Bifidobacteriaceae の減少が認められている.この腸内細菌の変化は,睡眠障害を中止して 2 週間後には消失していた.腸内細菌の変化は,腸管内代謝産物の変化をもたらし,睡眠障害を来したマウスの腸管内では,D- マンノース,クエン酸,プロピオン酸の利用低下が観察された.睡眠障害マウスの腸管内容物は in vitro で腸管細胞株のバリア機能を低下させたことから,睡眠障害マウスの腸内細菌は,腸管バリア機能障害を引き起こしている可能性が考えられた.実際に,これらのマウスの腸内細菌を無菌マウスへ移植したところ,睡眠障害を来したマウスの腸内細菌を移植さ れた無菌マウスでは,IL-6 などの催炎症性サイトカイン の血中濃度が増加を認め,インスリン抵抗性の増悪が認められた.またマクロファージなどの細胞膜に存在する CD14-TLR4-MD2 複合体(LPS 受容体)に LPS を輸送する Lipopolysaccharide-binding protein(LBP)の血中濃度も睡眠障害マウスでは増加を認めていた(22).このことから睡眠障害モデルでは,腸内細菌叢の変化と腸管バリア機能低下が生じ,血中への LPS 流入が増加していると考えられた.
ヒトにおいても腸内細菌の日内変動が検討され, Parabacteroides や Bulleida は日中に増加し夜間に減少する,Lachnospira は日中に減少し夜間に増加するなどの変動が認められることが明らかとなった(4).機能的にもマウスの所見と一致して,蛋白合成は日中に行われるなどの日内変動が存在することも示された.さらに,被験者に 8 時間程度の飛行機による移動により,いわゆる“時差ぼけ”(時差症候群)を引き起こすと,被 験者の腸内細菌では Firmicutes の増加,Bacteroidetes の減少が生じ,その“時差ぼけ”中の被験者の腸内細菌を無菌マウスに移植すると,平常時の腸内細菌を移植されたマウスに比較して体脂肪蓄積の促進,耐糖能の増悪が認められた.飛行後 2 週間経過し,時差症候群が解消した時の被験者の腸内細菌では,この腸内細菌の偏りは 解消し,個人特有の細菌叢に回復していた.
さらに,睡眠時間以外の食事を含めた生活パターンを等しくして,摂食の影響を排除した睡眠障害介入による 腸内細菌叢への影響も検討されている.健常者 9 名に睡眠時間約 4 時間を 2 日間と,約 8 時間を 2 日間にする介入を行い,睡眠以外の日常生活を等しくなるように介入する無作為クロスオーバー試験が行われた.2 日間の短時間の睡眠によって Firmicutes が増え,Bacteroidetes の減少が認められ,インスリン抵抗性と耐糖能の悪化が認められた(23).他にも 10 名の健常者における臨床研究から,10 時間の睡眠時間を 4 時間に制限した場合の血中代謝産物の変化が報告されており,腸内細菌の代謝産物であるピペコリン酸の増加が示されている(24).これらの知見は,ヒトにおいても睡眠障害は腸内細菌と腸管機能に影響を与えていることを示していると考えられる.
また睡眠障害には低酸素を伴う場合もあるが,低酸素は腸管機能と腸内細菌に影響を与えることも報告されている.間欠的低酸素が腸内細菌叢を変化させることがマウスモデルで示されており(25),ヒトにおいても睡眠時無呼吸症候群が,肥満と独立して血中 LBP の増加と関連していることが報告されている.間欠的な低酸素は腸内細菌と腸管バリア機能へ傷害を与えていると考えられる(26).
以上のモデル動物およびヒトにおける睡眠障害の検討から,睡眠障害は腸内細菌叢の正常な概日リズムを撹乱すると考えられる.In vivo の睡眠障害モデルでは,睡眠障害によるストレスの影響を否定できないため,腸内細菌に認められた変化が中枢時計の変化だけによるものかは明らかではない.しかし,時計遺伝子の異常モデルでも腸内細菌の概日リズムが消失していたことから,やはり睡眠障害による中枢時計の変調が,腸内細菌の日内変動を消失させたと考えられる.
腸内細菌を介した概日リズムと睡眠制御の可能性(図 3)
これまで述べたように,腸内細菌は中枢および末梢時計の支配を受け,消化管の機能を補うように概日リズム変動をしていると解釈できる.そこで,腸内細菌を介した宿主の概日リズムの回復,さらには睡眠制御の可能性が検討されている.
最近,腸内細菌自体が宿主の概日リズムに影響を与えることが無菌マウスを用いて示された.Leone らは,無菌マウスと通常マウスの視床下部内側基底部や肝臓の時計遺伝子 Bmal1 や Clock の発現を比較し,通常マウスでは既報通り概日リズムが認められたが,無菌マウスでは概日リズムが減弱していることを見いだした(18).本現象は食事の内容には影響を受けないことも明らかとなり,腸内細菌の存在が規則正しい概日リズムの発振に必須であることが明らかとなった.次に,腸内細菌が肝臓や視床下部内側基底部の概日リズムに影響を与える機序が検討され,腸内細菌の代謝産物である酪酸が日内 変動を認めていたことから,腸内細菌が産生する酪酸が注目された.肝オーガノイド(ヘパノイド)に酪酸を in vitro で与えると,Per2 や Bmal1 発現の概日リズム変動の亢進が観察された.そこで,無菌マウスに酪酸を 12 時間ごとに注射投与したところ,肝臓の時計遺伝子の概日リズムが確認され,視床下部内側基底部においても時計遺伝子の振幅が増強される傾向が認められた. これらのことから,腸内細菌は代謝産物を介して,宿主の概日リズムの形成に寄与していることが明らかとなった.無菌マウスと同様に,抗菌剤を投与して腸内細菌を減じたマウスにおいても,腸管上皮の Bmal1 と Cry1 の概日リズムが消失しTlr 発現の概日リズムが消失することや(27),腸内細菌の代謝産物の血中の概日リズムが消失し,肝臓の概日リズムも変化することなどが報告されている(28).したがって,腸内細菌の概日リズムを抗菌剤によって変化させることは,他の臓器の概日リズムにも影響を与え,中枢時計との同調にも変化を与える可能性があると考えられる.
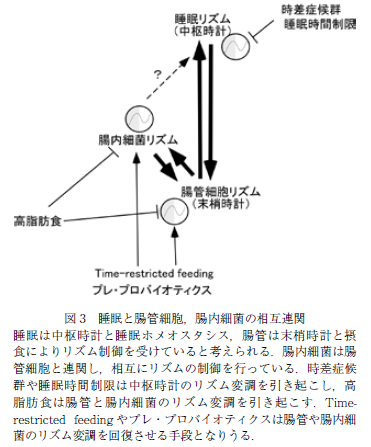
先述のように,末梢組織である腸管においても時計遺伝子による概日リズムが認められ,腸管機能に変動が認められるが,末梢臓器の概日リズムの同調には外部からの刺激が重要である.特に消化管においては,食事の摂取がそのトリガーとなることが知られており,腸管の概日リズムを回復させる方法として,摂食時間を制限する Time restricted feeding(TRF)が報告されている (19).モデルマウスにおいて同じエネルギー量の餌で あっても,24 時間自由摂食させた場合に比較して,1 日 9 時間未満などに摂食時間を制限すると(TRF),体脂肪蓄積の抑制と耐糖能悪化の予防が認められる.こ の TRF は様々な臓器の代謝異常を改善することが示されているが,腸内細菌に関しても,高脂肪食を自由摂食させたマウスに比較して,高脂肪食で TRF を施したマウスでは腸内細菌の多様性と日内変動の回復が認められていた.TRF が中枢時計に影響を与えうるかは明らかではないが,規則正しい食事パターンにより腸内細菌の多様性と日内変動を保持することが,中枢時計との同調と睡眠障害の予防に繋がる可能性がある.実際に末梢臓器が中枢時計に影響を与える例として,脂肪組織特異的 に Bmal1 を欠損させたマウスが知られており,本マウスでは,脂肪組織の概日リズムの変調により脂肪組織か ら血中への多価不飽和脂肪酸放出が低下し,視床下部の脂肪酸濃度が低下することで,食事リズムに変調が生じることが報告されている(29).この摂食による消化管 の時計遺伝子へのシグナルとしては,腸内細菌によって 脱抱合された胆汁酸が重要であることが報告されている (30).
概日リズムに加え,sleep homeostasis における睡眠圧力にも腸内細菌の関与が想定されている.1970 年代に細菌の細胞壁由来のムラミルペプチドが睡眠を促進することが見いだされ,その後,腸内細菌由来 LPS や炎症性サイトカイン(IL-1β,TNF-α,IL-18)などが睡眠を促す効果を有することが明らかとなった.軽度の感染症や微生物由来産物が,ラットやウサギではノンレム睡眠の時間を延長し深度を増すこと,またレム睡眠の時間を減らすことが報告されている(31, 32).感染症を有さないヒトにおいても,血中の IL-1β や TNF-α は概日リズム変動を示し,夜間に頂値となり明け方に低値となっており,入眠の契機となっている可能性が指摘されている(33).実際に,睡眠障害を高率に併発する慢性疲労症候群の患者では,LPS に対する血中の IgA と IgM が高値であり,腸管バリア機能の低下が推測されている(34).そこで,慢性疲労症候群の 21 名の患 者にエリスロマイシン 800 mg を 6 日間投与したところ,actigraphy で評価した睡眠時間の延長が認められ, Streptococcus の有意な減少など腸内細菌叢の変化も観察されている.また質問紙票で評価した睡眠の質は,被験者全体で有意な改善が認められていた(35).他にも抗菌剤の睡眠に対する影響が検討されており,19 人の 健常男性に対してミノサイクリン 200 mg またはアンピシリン 500 mg を単回投与したところ,ミノサイクリン はノンレム睡眠の割合を有意に減じ,その影響は 2 日間持続を認めた.レム睡眠には影響は認められず,またアンピシリンではノンレム睡眠,レム睡眠ともに影響は認められなかった(36).これらの知見は,腸内細菌に変化を与えることが睡眠の改善に繋がる可能性を示すものであろう.
抗菌剤を長期間投与することは実臨床では容易ではないため,プレ・プロバイオティクスを用いた睡眠障害改善の取り組みが行われている.Lactobacillus brevis の マウスへの 4 週間の投与により,身体活動度が増加し, 覚醒時間の延長が得られ,ノンレム睡眠が減じたとの報告がなされている(37).またラットにラクトフェリン を含むプレバイオティクスを離乳期から投与すると,成獣期に腸内細菌の多様性が増加し,電気ショックによる ノンレム睡眠の減少が予防可能であったとの報告もある (38).今後は臨床で同様な検討が期待されるが,一方で睡眠障害を有する患者では,消化器症状を訴えることも多いため,プレ・プロバイオティクスの投与による消化器症状の改善により睡眠の改善が得られる可能性も想定される.そのため交絡因子の調整を行った臨床試験が 必要であろう.
お わ り に
睡眠障害が腸内細菌の組成と機能に影響を与える機序,ならびに腸内細菌叢への介入による睡眠障害治療の可能性について述べた.疫学研究からは,睡眠の障害がインスリン抵抗性,肥満症,高血圧など生活習慣病の発症に密接に関連していることが示されており,またこれ らの疾患において dysbiosis が病態形成に重要な役割を担っていると多くの報告がなされている.腸内細菌は睡眠障害と生活習慣病の共通の基盤である可能性があり, 腸内細菌による代謝の分子機構を明らかとすることで, 睡眠の分子メカニズムが解明されていくことを期待したい.
引 用 文 献
(1) Ayas NT, White DP, Al-Delaimy WK, Manson JE, Stampfer MJ, Speizer FE, Patel S, Hu FB. A prospec- tive study of self-reported sleep duration and incident diabetes in women. Diabetes Care. 2003; 26: 380–384.
(2) Heianza Y, Kato K, Fujihara K, Tanaka S, Kodama S, Hanyu O, Sato K, Sone H. Role of sleep duration as a risk factor for type 2 diabetes among adults of differ- ent ages in Japan: the niigata wellness study. Diabet Med. 2014; 31: 1363–1367.
(3) Rutenfranz J, Colquhoun WP, Knauth P, Ghata JN. Biomedical and psychosocial aspects of shift work. A review. Scand J Work Environ Health. 1977; 3: 165– 182.
(4) Thaiss CA, Zeevi D, Levy M, Zilberman-Schapira G, Suez J, Tengeler AC, Abramson L, Katz MN, Korem T, Zmora N, Kuperman Y, Biton I, Gilad S, Harmelin A, Shapiro H, Halpern Z, Segal E, Elinav E. Transkingdom control of microbiota diurnal oscilla- tions promotes metabolic homeostasis. Cell. 2014; 159: 514–529.
(5) Liang X, Bushman FD, FitzGerald GA. Rhythmicity of the intestinal microbiota is regulated by gender and the host circadian clock. Proc Natl Acad Sci USA. 2015; 112: 10479–10484.
(6) Daan S, Beersma DG, Borbely AA. Timing of human sleep: recovery process gated by a circadian pace- maker. Am J Physiol. 1984; 246: R161–183.
(7) Borbely AA. A two process model of sleep regulation.Hum Neurobiol. 1982; 1: 195–204.
(8) Huang W, Ramsey KM, Marcheva B, Bass J. Circadian rhythms, sleep, and metabolism. J Clin Invest. 2011; 121: 2133–2141.
(9) Toh KL, Jones CR, He Y, Eide EJ, Hinz WA, Virshup DM, Ptacek LJ, Fu YH. An hPer2 phosphorylation site mutation in familial advanced sleep phase syn- drome. Science. 2001; 291: 1040–1043.
(10) Jones CR, Campbell SS, Zone SE, Cooper F, DeSano A, Murphy PJ, Jones B, Czajkowski L, Ptacek LJ. Familial advanced sleep-phase syndrome: a short- period circadian rhythm variant in humans. Nat Med. 1999; 5: 1062–1065.
(11) Ebisawa T, Uchiyama M, Kajimura N, Mishima K, Kamei Y, Katoh M, Watanabe T, Sekimoto M, Shibui K, Kim K, Kudo Y, Ozeki Y, Sugishita M, Toyoshima R, Inoue Y, Yamada N, Nagase T, Ozaki N, Ohara O, Ishida N, Okawa M, Takahashi K, Yamauchi T. Association of structural polymorphisms in the human period3 gene with delayed sleep phase syndrome. EMBO Rep. 2001; 2: 342–346.
(12) Konturek PC, Brzozowski T, Konturek SJ. Gut clock: implication of circadian rhythms in the gastrointestinal tract. J Physiol Pharmacol. 2011; 62: 139–150.
(13) Pan X, Hussain MM. Clock is important for food and circadian regulation of macronutrient absorption in mice. J Lipid Res. 2009; 50: 1800–1813.
(14) Scheving LA. Biological clocks and the digestive system. Gastroenterology. 2000; 119: 536–549.
(15) Laermans J, Vancleef L, Tack J, Depoortere I. Role of the clock gene Bmal1 and the gastric ghrelin-secreting cell in the circadian regulation of the ghrelin-GOAT system. Sci Rep. 2015; 5: 16748.
(16) LeSauter J, Hoque N, Weintraub M, Pfaff D W, Silver R. Stomach ghrelin-secreting cells as food-entrainable circadian clocks. Proc Natl Acad Sci USA. 2009; 106: 13582–13587.
(17) Froy O, Chapnik N. Circadian oscillation of innate immunity components in mouse small intestine. Mol Immunol. 2007; 44: 1954–1960.
(18) Leone V, Gibbons SM, Martinez K, Hutchison AL, Huang EY, Cham CM, Pierre JF, Heneghan AF, Nadimpalli A, Hubert N, Zale E, Wang Y, Huang Y, Theriault B, Dinner AR, Musch MW, Kudsk KA, Prendergast BJ, Gilbert JA, Chang EB. Effects of diurnal variation of gut microbes and high-fat feeding on host circadian clock function and metabolism. Cell Host Microbe. 2015; 17: 681–689.
(19) Zarrinpar A, Chaix A, Yooseph S, Panda S. Diet and feeding pattern affect the diurnal dynamics of the gut microbiome. Cell Metab. 2014; 20: 1006–1017.
(20) Voigt RM, Forsyth CB, Green SJ, Mutlu E, Engen P, Vitaterna MH, Turek FW, Keshavarzian A. Circadian disorganization alters intestinal microbiota. PLoS One. 2014; 9: e97500.
(21) Summa KC, Voigt RM, Forsyth CB, Shaikh M, Cavanaugh K, Tang Y, Vitaterna MH, Song S, Turek FW, Keshavarzian A. Disruption of the circadian clock in mice increases intestinal permeability and promotes alcohol-Induced hepatic pathology and inflammation. PLoS One. 2013; 8: e67102.
(22) Poroyko VA, Carreras A, Khalyfa A, Khalyfa AA, Leone V, Peris E, Almendros I, Gileles-Hillel A, Qiao Z, Hubert N, Farre R, Chang EB, Gozal D. Chronic sleep disruption alters gut microbiota, induces systemic and adipose tissue inflammation and insulin resistance in mice. Sci Rep. 2016; 6: 35405.
(23) Benedict C, Vogel H, Jonas W, Woting A, Blaut M, Schurmann A, Cedernaes J. Gut microbiota and glucometabolic alterations in response to recurrent partial sleep deprivation in normal-weight young individuals. Mol Metab. 2016; 5: 1175–1186.
(24) Weljie AM, Meerlo P, Goel N, Sengupta A, Kayser MS, Abel T, Birnbaum MJ, Dinges DF, Sehgal A. Oxalic acid and diacylglycerol 36:3 are cross-species markers of sleep debt. Proc Natl Acad Sci USA. 2015; 112: 2569–2574.
(25) Moreno-Indias I, Torres M, Montserrat JM, Sanchez- Alcoholado L, Cardona F, Tinahones FJ, Gozal D, Poroyko VA, Navajas D, Queipo-Ortuno MI, Farre R. Intermittent hypoxia alters gut microbiota diversity in a mouse model of sleep apnoea. Eur Respir J. 2015; 45: 1055–1065.
(26) Kheirandish-Gozal L, Peris E, Wang Y, Tamae Kakazu M, Khalyfa A, Carreras A, Gozal D. Lipopolysaccharide-binding protein plasma levels in children: effects of obstructive sleep apnea and obesity. J Clin Endocrinol Metab. 2014; 99: 656–663.
(27) Mukherji A, Kobiita A, Ye T, Chambon P. Homeostasis in intestinal epithelium is orchestrated by the circadian clock and microbiota cues transduced by TLRs. Cell. 2013; 153: 812–827.
(28) Thaiss CA, Levy M, Korem T, Dohnalova L, Shapiro H, Jaitin DA, David E, Winter DR, Gury-BenAri M, Tatirovsky E, Tuganbaev T, Federici S, Zmora N, Zeevi D, Dori-Bachash M, Pevsner-Fischer M, Kartvelishvily E, Brandis A, Harmelin A, Shibolet O, Halpern Z, Honda K, Amit I, Segal E, Elinav E. Microbiota diurnal rhythmicity programs host transcriptome oscillations. Cell. 2016; 167: 1495–1510.
(29) Paschos GK, Ibrahim S, Song WL, Kunieda T, Grant G, Reyes TM, Bradfield CA, Vaughan CH, Eiden M, Masoodi M, Griffin JL, Wang F, Lawson JA, Fitzgerald GA. Obesity in mice with adipocyte-specific deletion of clock component Arntl. Nat Med. 2012; 18: 1768–1777.
(30) Govindarajan K, MacSharry J, Casey PG, Shanahan F, Joyce SA, Gahan CG. Unconjugated bile acids influence expression of circadian genes: a potential mechanism for microbe-host crosstalk. PLoS One. 2016; 11: e0167319.
(31) Krueger JM, Bacsik J, Garcia-Arraras J. Sleep- promoting material from human urine and its relation to factor S from brain. Am J Physiol. 1980; 238: 116– 123.
(32) Krueger JM, Pappenheimer JR, Karnovsky ML. The composition of sleep-promoting factor isolated from human urine. J Biol Chem. 1982; 257: 1664–1669.
(33) Galland L. The gut microbiome and the brain. J Med Food. 2014; 17: 1261–1272.
(34) Maes M, Mihaylova I, Leunis JC. Increased serum IgA and IgM against LPS of enterobacteria in chronic fatigue syndrome (CFS): indication for the involvement of gram-negative enterobacteria in the etiology of CFS and for the presence of an increased gut-intestinal permeability. J Affect Disord. 2007; 99: 237–240.
(35) Jackson ML, Butt H, Ball M, Lewis DP, Bruck D. Sleep quality and the treatment of intestinal microbiota imbalance in chronic fatigue syndrome: a pilot study. Sleep Sci. 2015; 8: 124–133.
(36) Nonaka K, Nakazawa Y, Kotorii T. Effects of antibiotics, minocycline and ampicillin, on human sleep. Brain Res. 1983; 288: 253–259.
(37) Miyazaki K, Itoh N, Yamamoto S, Higo-Yamamoto S, Nakakita Y, Kaneda H, Shigyo T, Oishi K. Dietary heat-killed Lactobacillus brevis SBC8803 promotes voluntary wheel-running and affects sleep rhythms in mice. Life Sci. 2014; 111: 47–52.
(38) Thompson RS, Roller R, Mika A, Greenwood BN, Knight R, Chichlowski M, Berg BM, Fleshner M. Dietary prebiotics and bioactive milk fractions improve NREM sleep, enhance REM sleep rebound and attenuate the stress-induced decrease in diurnal temperature and gut microbial alpha diversity. Front Behav Neurosci. 2016; 10: 240.
ストレス減で活力ある未来に貢献する、株式会社RUDDER。
特許出願済み。まぶしい!うるさい!寒い!を解消。安眠家具「Sleep Labo」国産家具の安心安全をお届けします。
うるさいいびき、止まらない、止められない。でも大丈夫。 いびきを解決する唯一の方法。


