スマホ用望遠レンズを使って撮影してみました。どうしても端のほうがゆがむのは、そういう価格のレンズだということです。
虫や鳥などを撮りたくても、近づくと逃げられる。スマホの望遠機能では足りなかったので、望遠がほしいと思ったのです。後は被写体を探さなくては。
本日は「ストレスと精神障害」という獨協大学の論文をご紹介します。
ストレスに影響を被らない精神障害はないと言ってもよく、遺伝的要因を含む脆弱性を有する個人に何らかのストレス負荷が加わり発症するうつ病, 外傷後ストレス障害(PTSD), 摂食障害を事例として紹介しています。
ストレスと精神障害
獨協医科大学 精神神経医学教室
秋山 一文 斉藤 淳
抄 録
脳には視床下部―下垂体―副腎皮質系(hypothalanic-pituitary-adrenocortical axis, HPA系)とノルアドレナリン系というストレス反応を担う2つの系が存在する. 急性のストレス反応を終焉させるためにHPA系全体に負のフィードバックが作動する.しかしストレス反応は長期化すればいわば「両刃の刃」としての性質をもつようになる.その引き金になるのがストレスの反復による海馬神経細胞への障害で,これにはbrain derived neurotrophic factor (BDNF)の減少が関与しているかもしれない、またストレスの反復によって脳内ノルアドレナリンの放出は感作される.精神障害は何らかの意味でストレスの影響を被るが、特にストレス反応を担う HPAの制御の障害が示唆される精神障害としてうつ病, 外傷後ストレス障害(posttraumatic stress disorder, PTSD), 摂食障害を取り上げた。 いずれも遺伝的要因を含む脆弱性を有する個人に何らかのストレス負荷が加わり発症するという図式に共通点がある.しかしデキサメサゾン抑制試験で評価した HPAの制御障害の方向性はうつ病では非抑制, PTSDでは過剰抑制と相反している. MRIによるうつ病の画像研究では海馬の萎縮を認めた報告が多い.これがいつから始まるかという問題はストレスによる海馬神経細胞への障害の時間的経過という点で興味深いが更に今後の検討が必要と考えられる.近年, 児童虐待が社会問題化しているが、被虐待児が後年になってうつ病, あるいはPTSD など深刻な精神障害を高率に発症することが見いだされている.このようにストレスと精神障害との関係は大きな広がりを見せつつある。
- ストレス反応を担う系として脳
個体は外的環境要因(ストレッサー)が加えられると,適応のために生体内環境を変化させる.これがストレス反応である1.2. ストレス研究の歴史をひもとくと, Selye Hは「一般適応症候群」として温度, 拘束など物理的なストレッサーによって生じる一定の身体的変化(副腎皮質肥大, 胸腺萎縮, 胃潰瘍)を記載し,同時にこれらの生体反応に視床下部―下垂体―副腎皮質系(hypothalamic-pituitary-adrenocortical axis, 以下と HPA系と略)が関わっていることを強調した. この先駆的な業績はストレス反応が緊急時における生体防御としての機能をもつ反面, 長期化すれば様々な疾患の原因になるという,いわば「両刃の刃」としての性質をもっことを示唆した点で、その後のストレス研究を方向づけた。
「今日では, ストレスの概念はストレッサーが物理的要因にとどまらず心理的要因まで拡大されて捉えられることが通常で, 同時にストレス反応を担う系として脳の関与が重要視されている.特に視床下部,大脳辺縁系(海馬, 扁桃体), 前頭葉など感情, 記憶, 摂食行動を制御する部位の機能がストレスによって損なわれるとうつ病, 外傷後ストレス障害(posttraumatic stress disorder, PTSD), 摂食障害といった精神障害につながりやすい.一方, 自律神経系, 内分泌系, 免疫系は互いに連関していることが知られている。ストレス反応はこれらの連関に大きな影響を及ぼす。 特にうつ病では, HPA系の亢進によって, 免疫反応の低下, 内臓脂肪の増加,高血圧, インシュリン抵抗性など様々な身体疾患を併発しやすいことがよく知られている(図1).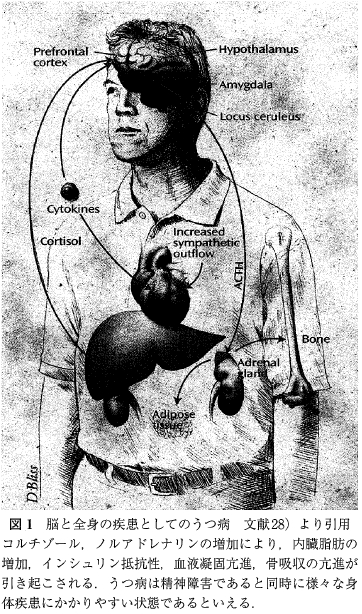
視床下部の室傍核(paraventricular nucleus, PVN) には副腎皮質刺激ホルモン(corticotropin releasing hormone, CRH)を合成する小細胞群が存在する. CRHを含む神経線維は正中隆起部外層部に至り,軸索輸送されたCRHは神経終末から下垂体門脈に分泌され, 下垂体前葉のadrenocorticotropin(ACTH)産生細胞を刺激する、引き続いて下垂体からの ACTH, 副腎皮質からの glucocorticoid(ヒトではコルチゾール)の分泌が促される.急性ストレス反応によって分泌されたコルチゾールは海馬やPVNその他に存在するコルチゾールに対するレセプター(glucocorticoid receptor (GR)とmineralcorticoid recepor (MR))に作用する.そしてこれらのレセプターの刺激がPVNのCRHの合成に対し抑制的に作用するため、急性ストレス反応は終焉する(負のフィードバック).
- ストレス曝露と海馬神経細胞
しかし高いレベルのコルチゾールは海馬の神経細胞を障害することが知られている。ストレス曝露と海馬神経細胞の障害との関係には神経成長因子が大きな役割を演じている. 神経成長因子のなかでも brain derived neurotrophic factor (BDNF)は脳内に広汎に分布し,神経細胞の分化, 成長, そして成体に達した個体に於いて神経細胞の生存維持に大きな役割を担っている。ストレスは海馬のCA1, CA3の神経細胞と歯状核の顆粒細胞のBDNFの量を急速にしかも長期にわたって減少させる。中枢神経系では神経細胞は新生されないとされてきたが、例外的に海馬の歯状回では顆粒細胞が新たに作られ、これらがCA3錐体細胞と機能的なシナプスを形成することが明らかにされている. 顆粒細胞の神経新生(neurogenesis)は記憶形成に何らかの役割をもっていると考えられる. ストレスにより HPA系が活性化されコルチゾール濃度が上昇すると歯状回の顆粒細胞の新生が抑制され,一方で海馬CA3の神経細胞は樹状突起の短縮により萎縮する(図2).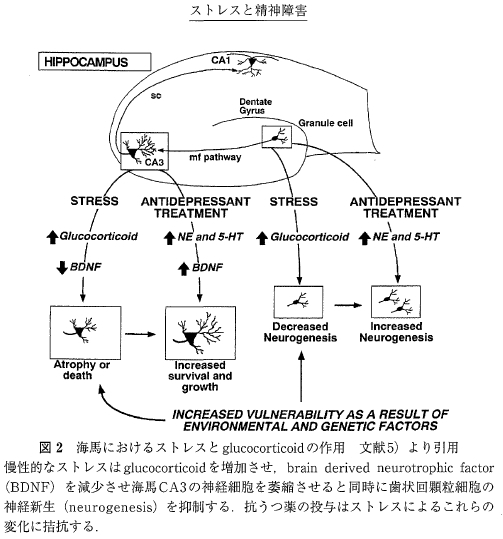
海馬CA3領域における変化は歯状回からの苔状線維終末からのグルタミン酸放出をコルチゾールが促進させ, コルチゾールとグルタミン酸が相乗的に働くために起こるとされる. このようにして海馬の神経細胞を要とした負のフィードバックは破綻し,それはさらにHPA系を亢進させるという悪循 環を招く、同時にストレス曝露による海馬の神経細胞の障害は HPA系への抑制減弱を招くだけでなく認知機能の障害をもたらすと考えられている。ストレスによる歯状回顆粒細胞の新生の抑制は抗うつ薬の投与によって阻止されることが実験的に示されている。
- ストレス反復によるノルアドレナリンの放出亢進
HPA系と密接な関係を保ちながらストレス応答に重要な役割を担っているのがノルアドレナリンである. 脳のノルアドレナリン神経系の細胞体は主として青斑核に存在し,ほとんどあらゆる脳部位に投射しており, 覚醒度 注意 学習, 記憶など多彩な機能と関係していると考えられている, 拘束ストレスや電撃ストレスといった物理的なストレスだけでなく動物実験でも心理的なストレスの負荷で脳内ノルアドレナリンの放出が亢進することが示されている. 心理的なストレスを動物実験で調べるには,透明なプラスチックの壁で仕切られた区画に一匹ずつ動物を置き、自らは電撃を受けない動物に周囲の動物が電撃を受けるのを目撃させる.この目撃によって当該動物は不快な視聴嗅覚刺激に曝露される.この方法を用いた心理的ストレスではノルアドレナリンの放出が視床下部, 扁桃核, 青斑体といった限られた脳部位で亢進し,しかも同ストレスの反復によって放出亢進は増強する. このことは物理的刺激によるストレスでは脳の広汎な部位にノルアドレナリン放出亢進がみられるが,同じ刺激の反復でこの効果に慣れが生じてくるのと対照的である. 一般にコントロールする手段がない ストレス, 予測がつかないストレス,発散できないストレス, 年をとってからのストレスにより脳のノルアドレナリン放出が広範な部位で生じたり,持続しやすい性質をもつ. 慢性的なストレス曝露歴をもつ個体では,その後のストレス曝露によりノルアドレナリン放出が増加する. このようなノルアドレナリン系反応の感作は PTSDでみられるストレス感作の原因の一部として考えられている, 青斑核に存在するノルアドレナリンニューロンは視床下部PVNのCRH ニューロンとストレス反応に於いて相互に増強しあう密接な関係を有する.
- 強い情動を刻印する扁桃体
大脳皮質,大脳辺縁系, 視床下部は密接に連結し,情動行動の表出に深く関与している。体性感覚を通じて収集された外界の情報は扁桃体に送られ, 知覚に反映される外部環境要因が個体にとって有益かまたはその存在を脅かすものかという評価が行われる.扁桃体で行われた評価の情報が視床下部に送られ自律神経反応や内分泌反応などの生理的反応として表出される. 日常よく経験されるように, 強い情動を伴う出来事, 例えば非常に嫌だったことや逆に非常に楽しかったことは強く記憶に刻まれる.このような強い情動を喚起する出来事の記憶に扁桃体の神経活動の増加が重要な役割を演じていると考えられている. 扁桃体中心核はPVN に次いで CRH ニューロンを豊富に含有する. ラットの扁桃体中心核に CRHを注入すると不安行動を惹起するといわれる.また, 扁桃体中心核における CRH の発現は glucocorticoid により増加する. 扁桃体中心核と視床下部PVNのCRH系は互いを刺激しあう悪循環を形成して, 慢性的なHPA系の 活性化と不安行動を引き起こしていく可能性が示唆されている。
- うつ病との関係 HPA制御異常, 脳画像, 小児虐待を焦点に
うつ病を含めた気分障害の分類についての考え方には長い歴史的経緯がある。当初は外的要因が絡んだexogenous depression と内的要因から生じる endogenous depression とを区別していたが, アメリカ精神医学会による精神疾患の診断・統計マニュアルの改訂3版からは症候学的な区別は曖昧という理由でその区別は撤廃された. 分類はともかくとして,離婚, 家族の死亡などの様々な負のライフイベントがうつ病の発症に重要な役割を演じていることは疑いがない、負のライフイベントがうつ病の発症前の1年間に高率に見られることが報告されている. ただしライフイベントとうつ病発症との関係に遺伝的な要因も関与しているといわれる.この分野では一卵性双生児のペアを含む多数の住民を母集団にした Kendler の研究が有名である. ライフイベントがうつ病を引き起こす1ヶ月あたりの確率はうつ病に罹患していなかった双生児ペアでは6.2%, 双方ともうつ病に罹患したことにある双生児ペアでは14.6%と後者で有意に高いと報告されている.一方で負のライフイベントとうつ病の発症の相関を示すオッズ比は一般の女性集団で5.64であるが、二卵性双生児ペアでは4.52, 一卵性双生児ペアの女性集団では3.58と順次低下していた. つまり遺伝的要因が強まるほどストレスに依存したうつ病発症の割合は減少する。そのため「うつ病発症にストレスが関与する」という言い方は実際には「遺伝 的に規定された脆弱性を持つ個体にストレスが付加されてうつ病が発症する」あるいは「遺伝的に規定された脆弱性を持つ個体は危険性のある環境を自ら選択しやすく,その結果, うつ病が発症する」と置き換えた方がよいという主張もある.
一方, ストレスの媒体である HPA系の制御障害とうつ病との関係については研究が重ねられてきた。 うつ病ではCRHの分泌過多のため脳脊髄液中のCRH 濃度が上昇する。不適切なフィードバックのためにコルチゾールの値が上昇し, 外因性 glucocorticoidのデキサメサゾン投与に対して血中コルチゾール値は抑制されにくい。うつ状態が回復するとこれらの HPA系の制御障害は正常化するため state marker とみなされることがある. うつ病に関するこういった病態と治療による変化を図3 に示す。しかしデキサメサゾンによる非抑制はうつ病で 半数しか認められないという感受性の低さとアルツハイマー病でもコルチゾール値の非抑制がみられるなど特異性も低いことが問題とされる。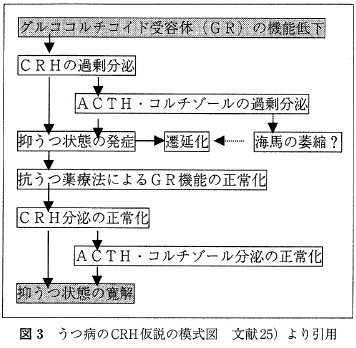
「先述したストレスによる海馬神経細胞の障害を示唆するような脳画像に関する研究が報告されている. それによると,少なくとも一部のうつ病患者で海馬の萎縮が認められるのは確実である.罹病期間, うつ病の重症度との関係などが検討され詳細は一致しない点があるものの, 初回エピソードで未服薬の患者と再発性エピソードの既往者を比較して後者のみに海馬体積の減少が認められたことから,海馬の萎縮は発症後の極めて早期に起こるものと考えられている. うつ病エピソードの反復で海馬が萎縮する機序として高コルチゾール血症への反復による神経細胞の脱落, グルタミン酸による神経障害、ストレスによるBDNFの産生低下, ストレスによる神経新生の低下などが示唆されている. しかしながら, HPA系の制御障害と画像所見を組み合わせて検討した報告は極めてすくなく,今後の検討が必要である。
近年, 児童虐待の通告例が増加している.我が国では平成17年度には35000件を越える勢いを示している。
虐待には子供への積極的な身体的攻撃や性的虐待であるabuse と子供のニーズを満たさない無関心, 養育の怠慢。拒否などの neglectがあり,両者を総称してmaltreatment という。虐待者の6割は実母といわれる. 子供の両親を加害者へと変える最大の要因は家族機能不全 が引き起こす「孤立」であるといわれる.一方, 子育てにあたる母親からみると,子育てが楽しみや生き甲斐になっていないという意識が指摘され,上述した児童虐待の背景にも子育てに関連した母親のストレスとの深い関係が考えられる.虐待体験は子供の認知・記憶過程や情動・行動特性に多くの影響を与える.近年の研究によると,児童期に受けた虐待によって子供が成長してからうつ病, 神経性大食症, パニック障害, PTSD, 境界性パーソナリティー障害の発症が増すことが明らかにされている. 男性に比べて女性のうつ病の有病率は2倍高いことはよく知られている.これには女性ホルモンの関与も示唆されているが,児童期に受けた虐待の性差という視点での研究が行われている.一般に少女は少年に比べて小児期に性的虐待を受ける頻度が12倍も高い. 小児期での虐待(性的虐待、両親の不和・離婚も含む) を経験した女性はこれを経験しなかった女性に比べて成人に達した後のうつ病の発症率が有意に高いことが報告されている. 小児期に受けた虐待が後年にうつ病発症への脆弱性を高める機序にも中枢 HPA系の活動亢進の関与が示唆されている2). この分野は動物実験によって仮説の検証がある程度可能なため多くの研究が行われている.さらにボランティアーを募った臨床研究で, 小児期での虐待の有無, 調査時点でのうつ状態の有無によって分けた4群に心理社会的ストレスを負荷すると,調査時点のうつ状態の有無に関わらず小児期に虐待を受けた群はそれを受けたことのない群に比べてストレス負荷間の血漿中の ACTHの値が有意に高かったこと, 小児期に虐待を受けて調査時点でうつ状態を有する群は血漿中のコルチゾールの値が他の群に比べて有意に高値であったと報告されている.いずれにしても児童期に受けた「心の傷」が後年に深刻な影響を与えることは想像に難くないと思われる。
- 外傷後ストレス障害との関係
先述したように個体の生存が脅かされる外的要因がストレッサーであり,このような状況に曝されると,怒り・恐れ・不安などの負の情動が引き起こされる.短期であっても個体の生存を脅かす度合いが強ければ、負の情動が長期にわたって続く. PTSDはそのような場合で, 診断規準では戦争, 大規模災害, 虐待など、 個人の生死に関わるような強い恐怖体験の後に再体験症状, 回避症状全般的反応の鈍麻、 持続性覚醒亢進などが1ヶ月以上持続し,それにより主観的苦痛や生活機能,社会機能に明らかな支障をきたすことを指すものをいう 2), 外傷後ストレスに暴露されたもののうち急性ストレス反応を生じるのは30-50%あり,さらにPTSDに発展するものはそのうちの50%であるとされている. 外傷後ストレスに暴露された者の全てがPTSDを発症するわけではないことから, PTSDの発症と持続に関係するいくつかの潜在的危険因子も検討されている。具体的には過去の虐待行動上の問題や心理的問題の既往, 合併精神障害, 遺伝的要因, 精神障害の家族歴などである. 再体験症状はフラッシュバックあるいは侵入的想起とも呼ばれPTSD の特徴的な症状である。この機序として、活動性が亢進したノルアドレナリン系ニューロンを介して、恐怖感を伴う出来事の記憶が扁桃体に過剰に固定され,このような記憶が侵入的想起として体験されることによってさらに記憶が強化されるという positive feedback 仮説が想定されている. うつ病と類似してPTSDでは脳脊髄液中の CRHの高値とMRIによる画像研究で海馬体積の減少が認められている. しかし,うつ病とは逆にPTSDでは HPA機能低下を示唆する所見が目立つ. 例えば 24時間尿中遊離コルチゾール量と血中のコルチゾール濃度は低下しており, デキサメサゾン抑制試験でのコルチゾール過剰抑制が認められる2). これらを明解に説明することは容易ではないが, PTSDでは視床下部由来のCRFが上昇し, CRF に対する ACTH反応の鈍化と海馬glucocorticoid 受容体に過感受性をもたらし,それがHPA系に過剰な負のフィードバックをもたらしていると考えられている。
- 摂食障害との関係
神経性無食欲症は若年女性に発症する摂食障害である.心理的ストレスによる摂食量の減少による極端な体重減少, やせ願望, 肥満恐怖, ボディーイメージの障害が主な症状である. 神経性無食欲症では血中 ACTHコルチゾール値は上昇し, 日内変動を欠き, 低用量のデキサメサゾンでは抑制が認められない. 脳脊髄液中のCRHも高値で持続的なHPA系の活動亢進状態が認められる, 脳内のCRH はストレス時での摂食行動を抑制していると考えられる. 体重が回復すると脳脊髄液中の CRH値は正常化する. 以上より本症ではHPA系が賦活化され,しかもそれは飢餓による影響では説明できず、視床下部に主な障害があることが示唆される。 神経性無食欲症の患者はストレスに対するコーピングスキル(ストレスを適切に処理する能力)が未熟であった り, 摂食障害を発病しやすい脆弱性や性格傾向があると いわれる。発病の契機になるストレスとしては、両親の不和, 母と祖母の嫁姑葛藤, 同胞の家庭内暴力など家庭内の問題があげられているが, ストレスが摂食中枢に影響を及ぼしやすい遺伝的素因も示唆されている。摂食障害の患者の家族内に摂食障害やうつ病の発症もあることから,素因となる候補遺伝子多型の検索が行われているが、未だはっきりした遺伝子多型は見いだされていない。
- おわりに
おおよそストレスによる影響を被らない精神障害はないといってもよい。ここでは取り扱わなかったが,統合失調症の発症と再発に及ぼすストレスの影響も大きなテーマであり,コーピングスキルや家族の感情表出に関して多くの研究がある.大学病院の精神科外来ではうつ病の患者が多く,また同一患者の再燃・再発もよく見受けられる.そのなかには軽微なストレスでも再燃・再発の徴候を示す者が少なくない、それらを見逃さないことは重要である。
文献
1) 大島久幸 芝崎 保:ストレスと本能および情動行動CLINICAL NEUROSCIENCE, 21 (9):1034-1036, 2003.
2) Selye H. : The general adaptation syndrome and the disease of adaptation. J Clin Endocrinol, 6:117-230, 1946.
3) Sapolsky RM. : Glucocorticoids and hippocampal atrophy in neuropsychiatric disorders. Arch Gen Psychiatry, 57 :925-935, 2000.
4)牧野晋也, 橋本浩三:神経内分泌系のストレス応答CLINICAL NEUROSCIENCE, 21(9): 1011-1014,2003.
5) Duman RS. : The neurochemistry of depressive disorders : preclinical studies. In : Neurobiology of Mental Illness. 2nd edition (Charney DS and Neslter EJ eds),p 421-439, Oxford University Press, New York, 2004.
6) McEwen BS. : Structural and functional plasticity inthe hippocampal formation : stress, adaptation, and disease. In : Neurobiology of Mental Illness. 2nd edition (Charney DS and Neslter EJ eds), p 558-583, Oxford University Press, New York, 2004.
7) Southwick SM, Bremner JD, Rasmusson A, Morgan III CA, Arnsten A, Charney DS. : Role of norepinephrine in the pathophysiology and treatment of posttraumatic stress disorder. Biol Psychiatry, 46 : 1192-1204, 1999.
8) 田中正敏:脳内ストレス応答とノルアドレナリン、CLINICAL NEUROSCIENCE, 21(9): 993-996, 2003.
9) Bremner JD. : Does stress damage the brain? Biol• Psychiatry, 45 : 797-805, 1999.
10) Koob GF. : Corticotropin-releasing factor, norepinephrine and stress. Biol Psychiatry, 46 : 1167–1180, 1999.
11) Boland RJ, Keller MB. : Diagnostic classification ofmood disorders : historical context and implications for neurobiology. In : Neurobiology of Mental Illness. 2nd edition (Charney DS and Neslter EJ eds), p 357–368, Oxford University Press, New York, 2004.
12) Thompson K, Henrie H. : Environmental stress in primary depressive illness. Arch Gen Psychiatry, 26 :130-132, 1972.
13) Kendler KS, Kessler RC, Walters EE, MacLean C,Meale MC, Heath AC, Eaves LJ. : Stressful life events, genetic liability, and onset of an episode of major depression in women. Am J Psychiatry, 152(6): 833-842, 1995.
14) Kendler KS. : Anna-Monika-Prize paper. Major depression and the environment : a psychiatric perspective. Pharmacopsychiatry, 31 (1): 5-9, 1998.
15) Kendler KS, Karkowski LM, Prescott CA. : Causal relationship between stressful life events and the onset of major depression. Am J Psychiatry, 156 (6) : 837-841, 1999.
16) Garlow SJ, Nemeroff CB. : The neurochemistry of depressive disorders : clinical studies. In : Neurobiology of Mental Illness. 2nd edition (Charney DS and Neslter EJ eds), p 440-460, Oxford University Press, NewYork, 2004.
17) MacQueen GM, Campbell S, McEven BS, Macdonald K, Amano S, Joffe RT, Nahmias C, Young LT.: Course of illness, hippocampal function, and hippocampal volume in major depression. Proc Natl Acad Sci USA, 100(3) : 1367-1392, 2003.
18) Sheline YI. : 3D MRI studies of neuroanatomic changes in unipolar major depression : the role of stress and inedical comorbidity. Biol Psychiatry, 48 : 791-800, 2000.
19) 森下紀代美:小児虐待の今、The Mainichi MedicalJournal, 2(8): 744-749, 2006.
20) 菅原ますみ:家庭でのメンタルヘルス 子育てストレスの問題をめぐって一, CLINICAL NEUROSCIENCE,20(5): 520-523, 2002.
21) Weiss EL, Longhurst JG, Mazure CM. : Childhoodsexual abuse as a risk factor for depression in women : psychosocial and neurobiological correlates. Am J Psychiatry, 156(6): 816-828, 1999.
22) Kaufman J, Plotsky PM, Nemeroff CB, Charney DS. :Effects of early adverse experiences on brain structures and function: clinical implications. Biol Psychiatry, 48 : 778-790, 2000.
23) Heim C, Newport DJ, Heit S, Graham YP, Wilcox M,Bonsall R, Miller AH, Nemeroff CB. : Pituitary-adrenal and autonomic responses to stress in women after sexual and physical abuse in childhood. JAMA, 284 :592-597, 2000.
24) 大渓俊幸、綱島浩一、加藤進昌、外傷後ストレスCLINICAL NEUROSCIENCE, 21(9): 1062-1065,2003.
25) 大嶋明彦:気分障害:ストレス性障害の神経内分泌と脳障害、精神科, 4(1): 4-8, 2004.
26) Yehua R. : Biology of posttraumatic stress disorder. JClin Psychiatry, 61 (suppl 7) : 14-21, 2000.
27)堀田眞理:ストレスと神経性食欲不振症. CLINICALNEUROSCIENCE, 21(9): 1053-1055, 2003.
28) Gold PW, Charney DS. : Images in Neuroscience. Diseases of the mind and brain. Am J Psychiatry, 150(11) : 1826, 2002.
ストレス減で活力ある未来に貢献する、株式会社RUDDER。
特許出願済み。まぶしい!うるさい!寒い!を解消。安眠家具「Sleep Labo」国産家具の安心安全をお届けします。
うるさいいびき、止まらない、止められない。でも大丈夫。 いびきを解決する唯一の方法。


